Questo farmaco viene richiamato immediatamente, avverte la FDA
Quando un produttore medico ricorda volontariamente un farmaco, la probabilità di effetti avversi può essere statisticamente bassa. Tuttavia, quando gli infortuni si verificano come risultato di droghe richiamate, possono essere gravi e persino la pericolosa per la vita, quindi i richiami dovrebbero essere presi sul serio e agire immediatamente. Continua a leggere per imparare quale farmaco viene attualmente richiamato negli Stati Uniti e cosa fare se pensi di averlo incontrato come paziente.
Correlati: se hai più di 60 anni, non prendere questo farmaco OTC ogni giorno, dicono i funzionari.
B. Braun Medical sta ricordando cinque lotti 0.9% di cloruro di sodio per iniezione USP 250 ml in Excel in circolazione attorno alla U.S.

B. Braun Medical Inc. sta ricordando volontariamente cinque lotti 0.9% di cloruro di sodio per iniezione USP 250 ml in Excel negli Stati Uniti. Gli ospedali e gli utenti hanno già questo farmaco in mano dopo che è stato distribuito in tutto il paese ai distributori domestici, secondo l'avviso di richiamo pubblicato sulla U.S. Sito Web Food & Drug Administration (FDA). AE0FCC31AE342FD3A1346EBB1F342FCB
La società ha annunciato il richiamo su Mar. 2 e la FDA ha pubblicato l'avviso su Mar. 3; Questo richiamo viene condotto con la conoscenza della FDA. I lotti richiamati includono J1E086, J1E204, J1E213, J1H137 e J1H138, che hanno tutte date di scadenza a maggio o giugno 2022.
Il farmaco ha varie applicazioni in merito all'idratazione e alle trasfusioni di sangue.
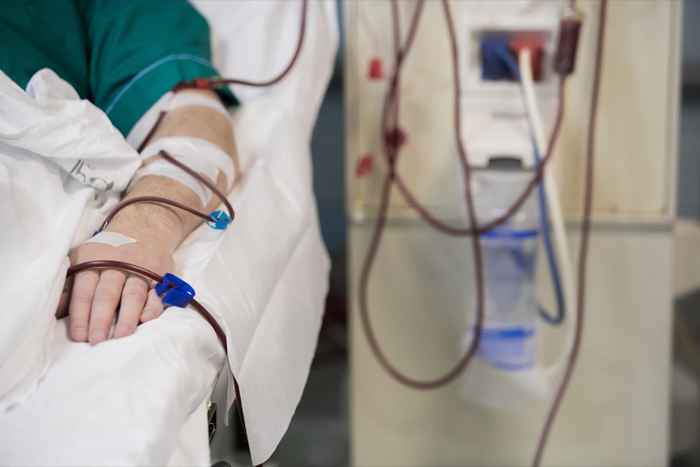
Queste soluzioni endovenose sono indicate per l'uso in adulti e bambini come fonti di elettroliti e acqua per l'idratazione. In particolare, questo farmaco è indicato per "sostituzione del liquido extracellulare, trattamento dell'alcalosi metabolica in presenza di perdita di liquidi e lieve deplezione di sodio", secondo l'avviso di richiamo. Lo 0.L'iniezione di cloruro di sodio al 9% USP in Excel è anche indicata per l'uso come soluzione di innesco nelle procedure di emodialisi e può essere utilizzata per iniziare e interrompere le trasfusioni di sangue senza emolizzare i globuli rossi.
Correlati: per le ultime notizie di richiamo consegnate direttamente alla tua casella di posta, iscriviti alla nostra newsletter quotidiana.
Il motivo del richiamo è che perde o un fluido inadeguato.

La società ha avviato il richiamo volontario a causa della perdita di fluido o del basso volume di riempimento all'interno dei contenitori. "Il rischio maggiore con una lenta perdita in qualsiasi preparazione di soluzione endovenosa è una rottura della sterilità, che rappresenta un rischio per il paziente esposto a un'infezione batterica o fungina", secondo l'avviso di richiamo. E sebbene la probabilità che ciò accada sia remoto, il problema potrebbe portare all'infezione del flusso sanguigno. Fortunatamente, tuttavia, b. Braun non ha ricevuto alcun rapporto di eventi avversi relativi a questo richiamo in questa fase.
Ecco cosa dovresti fare se potresti essere stato dato il farmaco richiamato e sperimentato effetti avversi.

La società sta avvisando i propri distributori e clienti tramite un avviso di richiamo ufficiale inviato tramite posta raccomandata certificata e sta organizzando il ritorno di tutti i prodotti richiamati. A qualsiasi strutture e distributori che dispongono di prodotti in magazzino viene chiesto di interrompere immediatamente l'uso e contattare la B. Braun Medical Inc. Dipartimento di assistenza clienti al numero 800-227-2862 dal lunedì al venerdì, 8 a.M. attraverso 6 p.M. EST per organizzare il ritorno del prodotto.
Se hai domande sul richiamo, contatta B. Braun per telefono durante le stesse ore lavorative. Se sei un paziente che pensa di aver riscontrato problemi relativi all'uso di questo farmaco, ti consigliamo di contattare il medico o il medico.
Inoltre, le reazioni avverse o i problemi di qualità riscontrati con l'uso di questo prodotto possono essere segnalati al programma di reporting eventi avversi MedWatch della FDA online. Altre opzioni di reporting includono la posta normale o il fax, che iniziano entrambi scaricando questo modulo di reporting. Completalo e ritorna all'indirizzo nel modulo pre-indirizzato o invia da Fax a 1-800-FDA-0178.
Correlati: non usare mai questo farmaco comune per più di una settimana, avvertono gli esperti.


